设为首页
设为首页 收藏本站
收藏本站导读:本文汇总了目前全国(不包括港澳台)31个省、直辖市、自治区及部分市级政府已颁布的支持生物医药产业创新、促进临床试验发展的最新政策措施中的主要内容和重点解析,以及截止到2021年12月30日全国各地已备案的药物临床试验机构和医疗器械临床试验机构总数。
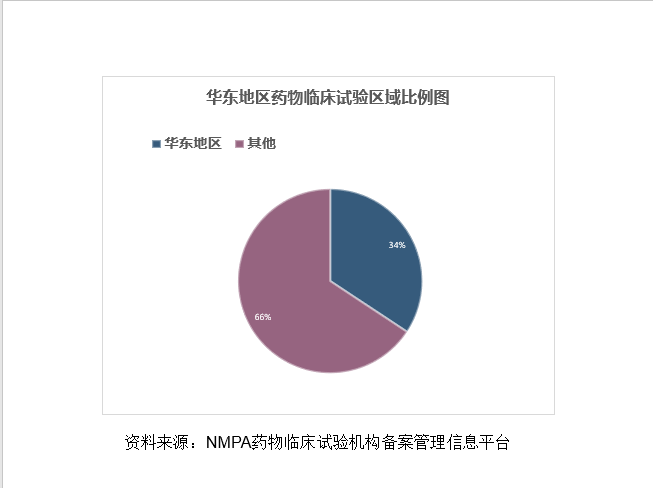
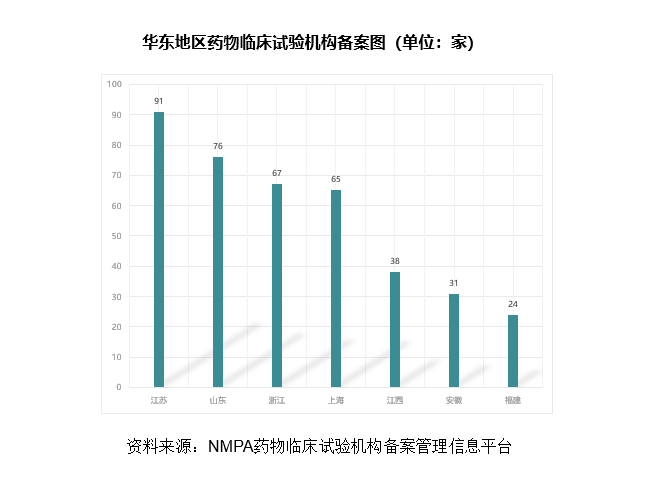
华东地区是中国经济发展最快的地区之一,尤其是长三角地区,近年来经济发展速度一直高于全国平均值。华东地区拥有上海、江苏、浙江、山东等生物医药产业大省/直辖市,临床资源优势明显,截止到2021年12月30日,该地区已完成备案的药物临床试验机构数量达到392家,占全国已备案机构总数的34.29%。
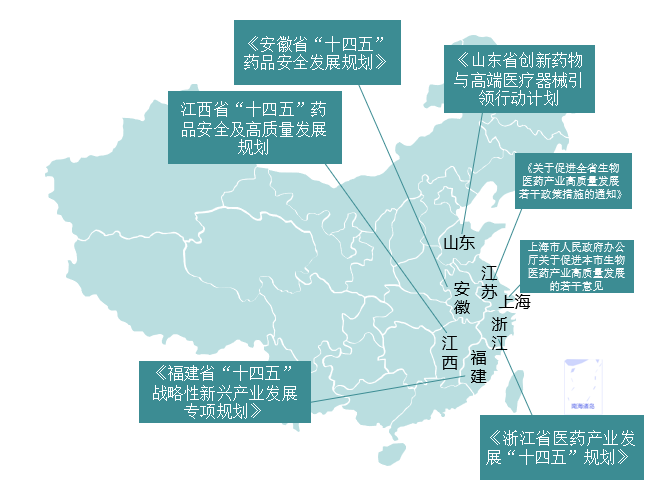
如上海市人民政府办公厅关于《促进本市生物医药产业高质量发展的若干意见 》中,对已在国内开展Ⅰ-Ⅲ期临床试验,由本市注册申请人获得许可并落地生产的1类化药、生物制品和中药,按不同临床试验阶段,择优给予不超过研发投入40%,最高分别为500万、1000万、3000万元资金支持;累计最高可达1亿元/单位/年。有条件的对在国内完成Ⅱ期、Ⅲ期临床试验,由本市注册申请人获得许可并落地生产的改良型新药,择优给予不超过研发投入20%,最高分别为500万、1000万元资金支持;累计不超过2000万元/单位/年。对进入国家和本市创新医疗器械特别审查程序的医疗器械产品,给予不超过200万元资金支持;对进入上述程序、首次取得医疗器械注册证并在本市生产的产品,再给予不超过研发投入40%,最高500万元资金支持;累计不超过1500万元/单位/年。建立本市医院伦理委员会协作审查机制,开展多中心临床研究协作伦理审查,探索对多中心临床研究实行伦理审查结果互认。统一本市临床生物样本库信息采集标准,实现数据汇集,优化样本共享机制。健全市级医院医企协同研究创新平台和临床试验数字化管理平台。支持有条件机构建设研究型医院,支持研究型医院开展自制体外诊断试剂试点和临床试验用药拓展性同情使用。支持有条件医疗机构挂牌院内临床研究中心。支持示范性研究型病房改造建设。
上海市黄浦区关于“聚焦转化医学引领生物医药产业高质量发展的扶持办法”提出:对首次取得GCP认证的,按照项目总投资的40%予以资助,最高不超过500万元。对符合GCP认证的临床试验机构,每新增1个GCP专业学科,给予50万元补贴,最高300万元/机构/年;按核定的对外服务累计金额给予最高10%补贴/年,最高500万元/单个机构/年。鼓励开展生物医药人体临床试验责任保险。鼓励参与国际、国内技术、行业、规划等标准的制定并有15-100万奖励。
《上海市浦东新区促进张江生物医药产业创新高地建设规定(草案)》(征求意见稿):完善政策支持体系,推动改革举措先行先试。设立浦东新区生物医药产业发展专家委员会,将促进人体细胞和基因产业发展纳入生物医药产业发展协调促进机制,药监部门可向做出承诺的生物医药企业在药物临床试验阶段核发《药品生产许可证》。鼓励开展临床真实世界数据应用研究并用于注册申报,推动药品、器械加快上市。支持国家级和市级医药临床研究中心建设,探索浦东新区研究型医院试点建设。组建生物医药专业职称评审委员会,对区域内非公领域生物医药产业专业技术人才开展职称评价;根据国家授权制定发布国际职业资格证书认可清单,研究国际职业资格与国内职称的衔接办法。
江苏省《关于促进全省生物医药产业高质量发展若干政策措施的通知》中明确指出:对已取得临床试验机构资质的医院,可用于临床研究的床位数量不少于30张,按照不低于30%的比例逐年递增,到2024年,临床研究床位数占医院编制床位总数比例将提高至10%左右。增加核定临床研究人员岗位。将临床试验项目视同科研课题,作为医务人员职称评定、职务晋升、绩效考核等的重要依据。
《苏州市生物医药及健康产业强链补链三年行动计划(2021-2023)》鼓励支持医疗机构积极申报备案,通过评估认证的医疗机构按专业给予奖励。鼓励积极参与本市企业临床试验研究,鼓励医务人员积极承担新药临床试验工作,参与机构和人员申报科研项目给予优先支持。作出贡献的人员给予奖励。
《浙江省医药产业发展“十四五”规划》:鼓励提升全省临床研究水平和临床试验能力建设。探索组建“临床试验加速器”,提升临床试验平均启动时间,加快临床试验样本有效供给,优化临床试验立项和伦理审查程序, 探索伦理前置,加快审查进度支持临床试验立项。
《杭州市人民政府办公厅关于加快生物医药产业高质量发展的若干意见》:建立全市临床研究伦理协作审查联盟制度,推动多中心临床研究伦理协作审查工作。探索建立多中心临床研究伦理审查结果互认制度。统一本市临床生物样本库信息采集标准,实现样本共享。对在临床研究及成果转化中做出主要贡献的人员,允许其职务科技成果转化现金奖励一次性计入当年本单位工资总额,但不纳入事业单位绩效工资总量。 以“揭榜挂帅”形式鼓励医疗机构与企业、研发机构联合开展临床应用研究。支持医疗机构建设临床研究型医院,联合建立技术转化平台,挂牌院内临床研究中心。
《福建省推进海洋药物与生物制品产业发展工作方案(2021—2023年)》中提到:要力争到2023年,建设2~3个国内领先的海洋微生物种质资源库、深海基因库、海洋微生物天然产物库等“蓝色药库”载体平台。加快开发抗菌、抗病毒、抗肿瘤、生育力保护等海洋创新药物,推进抗三阴性乳腺癌、抗结肠癌靶点新药等一批海洋创新药物临床研究和产业化。
详细内容请看下表:
各地政府支持医药创新和临床试验主要政策措施汇总与重点解析一览表(华东地区)
资料来源:各省、市、自治区政府官网